『2・4・1 pHと炭酸の解離
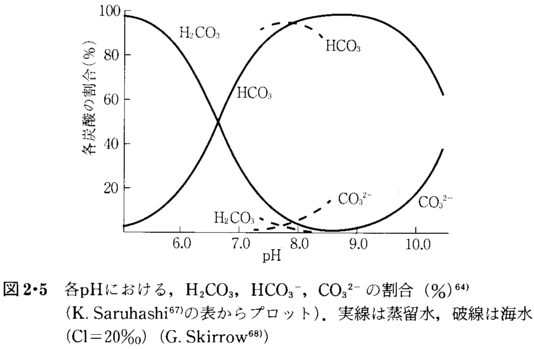
炭酸、ホウ酸、ケイ酸、リン酸などの弱酸は溶液のpHによって解離の状態が異なる。炭酸の例を述べると、pHによってCO2、H2CO3、HCO3-、CO32-の形態をとる。その関係を図2・5と表2・21に示す。

|
|
||
|
|
|
|
| 炭酸はなく、H+ | H2CO3−HCO3- | HCO3-−CO32-共存 |
海水以外の一般水のpHは4−8の間に入り、炭酸(H2CO3)と炭酸水素イオン(HCO3-)との共存系の範囲である(表2・21)。他から酸やアルカリが入っても、H2CO3−HCO3-系のpH緩衝作用でpHの変化は小さく押えられる。たとえば、湖水に酸性の鉱山廃水が入る場合、湖水にHCO3-イオンが存在する間はpHは4以下には下がらないが、HCO3-が酸により消費されてゼロになると、流入する酸の影響をまともに受けてpH4以下に湖水の酸性化が急激に進行する。
pHとして最も安定なところは、炭酸と炭酸水素イオンの濃度が等しいところで、それはpH6.5付近である(図2・5)。事実、pHとして不安定なpH4とか8付近の天然水は大変まれである。海水のpHが炭酸系の緩衝溶液として与えられているのであれば、海水のpHは、なぜ炭酸系として最も不安定な8になっているのであろうか、と筆者は思うのである。であるから、海水のpHは炭酸系で与えられているとの考えよりは、2・3・5節(b)のように、鉱物との平衡関係で維持されていると考えるべきであろう。』
64) Riley,J.P. and Chester,R.(1971): Introduction to Marine
Chemistry. Academic Press.
67) Saruhashi,K.(1955): Pap.Met.Geopys, Tokyo, 6, 38.
68) Skirrow,G.(1965): in Chemical Oceanography, I(1975).
Academic Press.